Το μεγάλο ταξίδι της επιστημονικής προόδου συνεχίστηκε με αμείωτη ταχύτητα και τη χρονιά που σε λίγες ημέρες μάς αποχαιρετά – μάλιστα το «τρένο» των επιτευγμάτων στην Ιατρική μάλλον… επιτάχυνε μέσα στο 2022, καθώς η σκιά της (συνεχιζόμενης μεν αλλά πιο διαχειρίσιμης δε) πανδημίας της COVID-19 δεν έπεφτε πλέον τόσο βαριά πάνω από τους ερευνητές και τους ειδικούς όσο τα προηγούμενα χρόνια. Ιδού μερικοί σημαντικοί «σταθμοί» αυτού του ταξιδιού που έχουν ως τελικό προορισμό τη βελτίωση της ζωής εκατομμυρίων ανθρώπων.
Οι ξενομεταμοσχεύσεις πήραν «σάρκα και οστά»
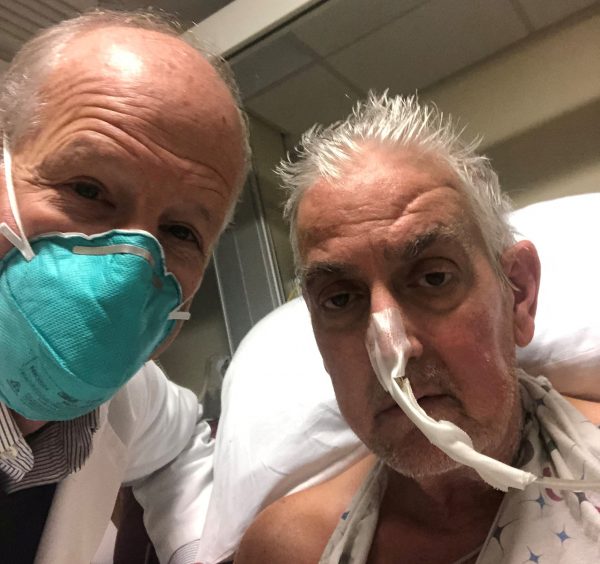
O 57χρονος Ντέιβιντ Μπένετ έγινε φέτος ο πρώτος άνθρωπος με καρδιακό μόσχευμα χοίρου (Reuters)
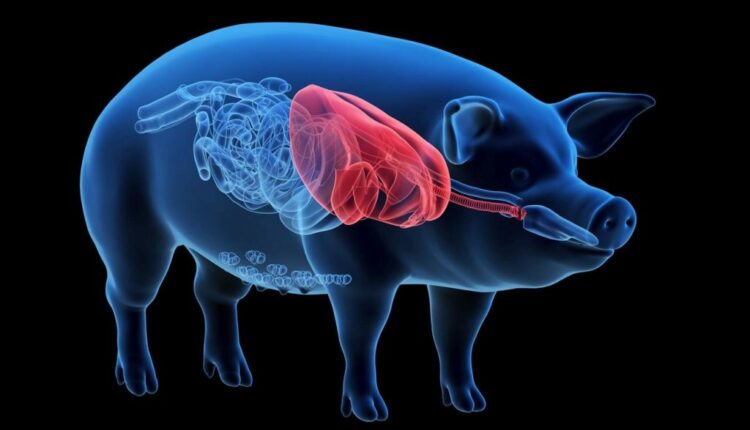
Στην αρχή του 2022 ένα πρωτοποριακό ιατρικό επίτευγμα έκανε τον γύρο του κόσμου: ένας 57χρονος Αμερικανός με καρδιακή ανεπάρκεια τελικού σταδίου έγινε ο πρώτος άνθρωπος παγκοσμίως ο οποίος έλαβε την καρδιά χοίρου – η αρμόδια Υπηρεσία Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) χορήγησε ειδική άδεια για τη διεξαγωγή της μεταμόσχευσης, καθώς ο ασθενής δεν είχε καμία άλλη ελπίδα επιβίωσης. Ο Ντέιβιντ Μπένετ υποβλήθηκε στην ξενομεταμόσχευση στο Ιατρικό Κέντρο του Πανεπιστημίου του Μέριλαντ στις 7 Ιανουαρίου και το όργανο του χοίρου το οποίο έλαβε είχε τροποποιηθεί γενετικώς από την αμερικανική εταιρεία Revivicor ώστε να ελαχιστοποιούνται οι πιθανότητες απόρριψής του (συγκεκριμένα είχαν αποσιωπηθεί τέσσερα γονίδια του χοίρου και είχαν προστεθεί έξι ανθρώπινα γονίδια στο μόσχευμα). Παρά το γεγονός ότι δύο μήνες μετά τη μεταμόσχευση ο ασθενής απεβίωσε εξαιτίας ξαφνικών σοβαρών επιπλοκών, η πρώτη αυτή ξενομεταμόσχευση θεωρήθηκε η αρχή μιας ιατρικής επανάστασης που υπόσχεται μελλοντικά να λύσει το διαχρονικό παγκόσμιο πρόβλημα της έλλειψης μοσχευμάτων.
Αντίστοιχη υπόσχεση δίνουν και οι ξενομεταμοσχεύσεις νεφρών χοίρων που διεξήχθησαν μέσα στο 2022 σε εγκεφαλικά νεκρούς λήπτες αποτελώντας μια πολύ καλή – και απαραίτητη – «πρόβα τζενεράλε» για τις μελλοντικές ξενομεταμοσχεύσεις νεφρών σε ασθενείς. Τον περασμένο Ιανουάριο ερευνητές από το Ολοκληρωμένο Ινστιτούτο Μεταμοσχεύσεων του Πανεπιστημίου της Αλαμπάμα ανέφεραν με δημοσίευσή τους στην επιθεώρηση «Τhe American Journal of Transplantation» ότι μεταμόσχευσαν με επιτυχία για πρώτη φορά παγκοσμίως δύο νεφρούς γενετικώς τροποποιημένου χοίρου σε έναν 57χρονο, τον Τζιμ Πάρσονς, ο οποίος κατά τη διάρκεια της ζωής του ήταν υποψήφιος δωρητής οργάνων, ωστόσο τα όργανά του δεν ήταν κατάλληλα για δωρεά. Η οικογένειά του έδωσε άδεια ώστε να διατηρηθεί σε μηχανική υποστήριξη το εγκεφαλικά νεκρό σώμα του προκειμένου να γίνει η δοκιμαστική μεταμόσχευση των νεφρών του χοίρου, μετά την αφαίρεση των δικών του νεφρών. Οι νεφροί είχαν τροποποιηθεί γενετικώς μέσω της διαγραφής τεσσάρων γονιδίων του χοίρου και της προσθήκης δέκα ανθρώπινων γονιδίων με στόχο να αποφευχθεί η απόρριψη των μοσχευμάτων. Μετά τη μεταμόσχευσή τους οι νεφροί ήταν σε θέση να φιλτράρουν το αίμα και να παράγουν ούρα ενώ δεν απορρίφθηκαν τις πρώτες 77 ώρες κατά τις οποίες διήρκεσε το πείραμα.
Τον περασμένο Μάιο μια άλλη ερευνητική ομάδα, αυτή τη φορά από το Πανεπιστήμιο της Νέας Υόρκης, προχώρησε επίσης σε ξενομεταμόσχευση νεφρών χοίρων σε δύο εγκεφαλικά νεκρούς ασθενείς. Στη συγκεκριμένη περίπτωση μαζί με τον κάθε ζωικό νεφρό οι ειδικοί μεταμόσχευσαν και τον θύμο αδένα του χοίρου, ο οποίος παράγει ανοσοκύτταρα βοηθώντας στην αποτροπή απόρριψης του μοσχεύματος. Σύμφωνα με δημοσίευση στην επιθεώρηση «The New England Journal of Medicine», κατά τις 54 ώρες που διήρκεσε η δοκιμή, η παραγωγή ούρων αυξήθηκε, γεγονός που αποτελούσε ένδειξη καλής λειτουργίας των μεταμοσχευμένων νεφρών, ενώ δεν κατεγράφη κάποια αντίδραση του ανοσοποιητικού συστήματος των ληπτών που θα μαρτυρούσε απόρριψη των μοσχευμάτων. Σημειώνεται ότι στο συγκεκριμένο πείραμα τα μοσχεύματα είχαν τροποποιηθεί γενετικώς με παρέμβαση σε ένα μόνο γονίδιο.
Και οι δύο ερευνητικές ομάδες μετά τα ενθαρρυντικά αυτά αποτελέσματα βρίσκονται σε διαδικασία αίτησης στην FDA για διεξαγωγή μικρού εύρους κλινικών δοκιμών σε νεφροπαθείς.
Οι ασθενείς με αιμορροφιλία κινδυνεύουν από ακατάσχετη αιμορραγία (CC-BY-SA-4.0)
Εγκρίσεις γονιδιακών θεραπειών για την αιμορροφιλία και στις δύο πλευρές του Ατλαντικού έγιναν μέσα στο 2022. Τον περασμένο Αύγουστο ο Ευρωπαϊκός Οργανισμός Φαρμάκων (ΕΜΑ) χορήγησε άδεια κυκλοφορίας υπό όρους στη θεραπεία Roctavian για την αιμορροφιλία Α – την πιο κοινή μορφή αιμορροφιλίας – που πλήττει περίπου 0,7 ανά 10.000 άτομα στην ΕΕ και αφορά μειωμένη ικανότητα πήξης του αίματος. Οι ασθενείς με αιμορροφιλία Α δεν μπορούν να παράγουν τον παράγοντα VIII, μια βασική πρωτεΐνη για την πήξη του αίματος, με αποτέλεσμα να είναι πιο επιρρεπείς σε αιμορραγίες, ακόμα και εν δυνάμει επικίνδυνες για τη ζωή τους.
Μέχρι σήμερα οι ασθενείς αυτοί λάμβαναν θεραπείες υποκατάστασης του Παράγοντα VIII, οι οποίες χορηγούνται σε ενέσιμη μορφή συστηματικά και διά βίου. Το Roctavian αποτελεί την πρώτη εγκεκριμένη γονιδιακή θεραπεία για την αιμορροφιλία Α. Η θεραπεία, η οποία είναι πολύ ακριβή – κοστίζει περί το 1,5 εκατ. ευρώ -. βασίζεται σε έναν αβλαβή αδενοϊό ο οποίος μεταφέρει το γονίδιο που κωδικοποιεί τον Παράγοντα VIII στα ηπατικά κύτταρα ωθώντας τα να παράγουν τον παράγοντα που λείπει. Η έγχυση γίνεται εφάπαξ, ωστόσο δεν είναι γνωστό πόσο διαρκεί το θεραπευτικό αποτέλεσμα.
Τα μέχρι στιγμής στοιχεία από την κύρια κλινική δοκιμή σε 134 άνδρες ασθενείς (η συμπτωματική νόσος είναι κυρίως γένους… αρσενικού) έδειξαν θετική επίδραση έως και για δύο έτη μετά από τη μία και μοναδική έγχυση, ενώ σε μια επιπρόσθετη δοκιμή σε λίγους ασθενείς η θεραπεία συνέχιζε να είναι αποτελεσματική έως και επί πέντε έτη. Από την κύρια κλινική δοκιμή προέκυψε ότι δύο χρόνια μετά τη χορήγηση της θεραπείας τα επίπεδα δραστηριότητας του Παράγοντα VIII αυξήθηκαν σημαντικά στους περισσότερους ασθενείς, ενώ τα ποσοστά αιμορραγίας μειώθηκαν κατά 85%, με αποτέλεσμα 128 από τους 134 εθελοντές να μη χρειάζονται πλέον θεραπεία υποκατάστασης. Σε ό,τι αφορούσε τις παρενέργειες, εμφανίστηκε σε κάποιες περιπτώσεις ηπατοτοξικότητα, η οποία αντιμετωπίστηκε με κορτικοστεροειδή, καθώς και πονοκέφαλος, πόνος στις αρθρώσεις και ναυτία.
Τον περασμένο μήνα εγκρίθηκε στις ΗΠΑ η ακριβότερη μέχρι στιγμής θεραπεία στον κόσμο που ήταν επίσης γονιδιακή και επίσης για την αιμορροφιλία – αυτή τη φορά για τη λιγότερο συχνή αιμορροφιλία Β που αφορά περίπου το 15% των ασθενών με τη συγκεκριμένη γενετική διαταραχή. Συγκεκριμένα η FDA ενέκρινε τη θεραπεία Hemgenix που χορηγείται ενδοφλεβίως εφάπαξ και κοστίζει 3,5 εκατ. δολάρια. Και παρότι η τιμή αυτή φαίνεται όντως αστρονομική, θεωρείται… λογική αν αναλογιστεί κάποιος πόσο κοστίζει σήμερα η μακροχρόνια θεραπευτική αντιμετώπιση των ασθενών – εκτιμάται ότι κάθε ασθενής με μέτρια έως σοβαρή αιμορροφιλία Β κοστίζει περί τα 21 έως 23 εκατ. δολάρια, καθώς χρειάζεται να λαμβάνει για ολόκληρη τη ζωή του θεραπείες υποκατάστασης.
Η αιμορροφιλία Β προκαλείται από την έλλειψη ή ανεπάρκεια μιας πρωτεΐνης που ονομάζεται Παράγοντας ΙΧ και η οποία είναι απαραίτητη στην πήξη του αίματος και μέχρι τώρα οι ασθενείς χρειαζόταν να λαμβάνουν προφυλακτική ενέσιμη αγωγή εφ’ όρου ζωής. Στην κλινική δοκιμή της οποίας ηγήθηκε ο καθηγητής Παιδιατρικής και Παθολογίας του Πανεπιστημίου του Μίσιγκαν Στίβεν Πάιπ συμμετείχαν 54 ενήλικοι άνδρες. Διαπιστώθηκε ότι 18 μήνες μετά τη χορήγηση της εφάπαξ θεραπείας, ο Παράγοντας ΙΧ αυξήθηκε σημαντικά, ενώ η συχνότητα αιμορραγιών μειώθηκε σε τέτοιον βαθμό ώστε οι ασθενείς σταμάτησαν τη συστηματική λήψη της θεραπείας υποκατάστασης του Παράγοντα ΙΧ. Η θεραπεία βρίσκεται υπό αξιολόγηση και στην Ευρώπη από τον ΕΜΑ.
Εγινε μετάγγιση «τεχνητού» αίματος σε ανθρώπους
Ερυθρά αιμοσφαίρια που παρήχθησαν στο εργαστήριο έφτασαν στο στάδιο των κλινικών δοκιμών
Για πρώτη φορά παγκοσμίως αίμα «εργαστηρίου» μεταγγίστηκε σε ανθρώπους στο πλαίσιο κλινικής δοκιμής (RESTORE) η οποία διεξάγεται στη Βρετανία. Οι επιστήμονες του βρετανικού Εθνικού Συστήματος Υγείας (NHS) και διαφόρων πανεπιστημίων ανέφεραν τον περασμένο Νοέμβριο ότι έχουν χορηγήσει μέχρι στιγμής σε δύο εθελοντές «τεχνητό» αίμα σε πολύ μικρή ποσότητα – δεν ξεπερνούσε τις δύο κουταλιές – προκειμένου να δουν πώς δρα στον ανθρώπινο οργανισμό. Σύμφωνα με τους ερευνητές, τα δύο άτομα που έλαβαν το αίμα εργαστηρίου, η διαδικασία καλλιέργειας του οποίου διαρκεί περί τις τρεις εβδομάδες, δεν έχουν εμφανίσει παρενέργειες. Συνολικά στην κλινική δοκιμή RESTORE αναμένεται να συμμετάσχουν τουλάχιστον 10 υγιείς εθελοντές που θα λάβουν δύο μίνι μεταγγίσεις με διαφορά τεσσάρων μηνών – οι εθελοντές θα λάβουν με τυχαία σειρά το αίμα εργαστηρίου αλλά και αίμα που θα προέρχεται από δότη. Στο πλαίσιο της δοκιμής οι επιστήμονες θα επικεντρωθούν στα ερυθρά αιμοσφαίρια, τα κύτταρα εκείνα που μεταφέρουν το οξυγόνο στους ιστούς του σώματος. «Αυτή η παγκοσμίως πρωτοποριακή έρευνα θέτει τις βάσεις σε ό,τι αφορά την ανάπτυξη ερυθρών αιμοσφαιρίων που θα μπορούν να χρησιμοποιηθούν με ασφάλεια για τη μετάγγιση αίματος σε άτομα με παθήσεις όπως η δρεπανοκυτταρική αναιμία» ανέφερε ο Φαρούχ Σα, ιατρικός διευθυντής Μεταγγίσεων στο Τμήμα για το Αίμα και τις Μεταμοσχεύσεις του NHS.
Δημιουργήθηκαν ινσουλινο-παραγωγά κύτταρα στο εργαστήριο
H ινσουλίνη παράγεται από εξειδικευμένα κύτταρα στο πάγκρεας (Berkshire Community College)
Από το εργαστήριο «ξεφουρνίστηκαν» για πρώτη φορά τη χρονιά που σε λίγο τελειώνει πλήρως λειτουργικά κύτταρα του παγκρέατος που παράγουν ινσουλίνη, όπως ανέφεραν ερευνητές από τη Φινλανδία και τη Σουηδία. Τα κύτταρα αυτά εγχύθηκαν μάλιστα με επιτυχία σε ποντίκια, ανοίγοντας τον δρόμο για αποτελεσματική θεραπεία του διαβήτη και στους ανθρώπους.
Σήμερα κάποιοι ασθενείς με διαβήτη λαμβάνουν β-ινσουλινοπαραγωγά κύτταρα του παγκρέατος από πτωματικούς δότες – πρόκειται όμως για μια διαδικασία που συναντά δυσκολίες στην ευρεία εφαρμογή της. Ετσι ερευνητές ανά τον κόσμο έχουν στραφεί στα βλαστικά κύτταρα προκειμένου να αποφύγουν τον «σκόπελο» των κυττάρων από δότες. Ωστόσο οι μέχρι τώρα προσπάθειες «σκοντάφτουν» στο ότι τα κύτταρα που παράγονται από τα βλαστοκύτταρα δεν επιτυγχάνουν επαρκή έκκριση ινσουλίνης.
Στο πλαίσιο της μελέτης τους που δημοσιεύθηκε τον περασμένο Μάρτιο στην επιθεώρηση «Νature Biotechnology» οι φινλανδοί και σουηδοί ερευνητές σημείωσαν ότι ξεπέρασαν τα εμπόδια, αφού κατάφεραν να μετατρέψουν βλαστοκύτταρα σε ώριμα κύτταρα που μιμούνται τα β-κύτταρα στη δομή και στη λειτουργία τους παράγοντας ινσουλίνη. Η λειτουργικότητα και η αποτελεσματικότητα των κυττάρων σε ό,τι αφορούσε την έκκριση ινσουλίνης πιστοποιήθηκε σε καλλιέργειες κυττάρων αλλά και σε πειράματα σε ποντίκια. Επόμενο βήμα για την ερευνητική ομάδα είναι να επιβεβαιώσει τα ευρήματά της και στους ανθρώπους.
Βλαστικά κύτταρα προσέφεραν ίαση από τον ΗΙV
Σωματίδια του ιού HIV (κίτρινο) την ώρα που εξέρχονται από λεμφοκύτταρο (CDC/ C. Goldsmith, P. Feorino, E. L. Palmer, W. R. McManus)
O τρίτος ασθενής παγκοσμίως – επρόκειτο μάλιστα για την πρώτη γυναίκα – θεραπεύθηκε μέσα στο 2022 από τον ιό HIV του AIDS χάρη σε βλαστοκύτταρα. Η ασθενής υποβλήθηκε στη βλαστοκυτταρική θεραπεία λόγω της λευχαιμίας από την οποία έπασχε και έλαβε κύτταρα του ομφαλοπλακουντιακού αίματος που είναι πιο εύκολα διαθέσιμα από τα ενήλικα βλαστοκύτταρα που χρησιμοποιούνται συχνά σε περιπτώσεις μεταμοσχεύσεων μυελού των οστών. Ενα επιπρόσθετο πλεονέκτημα των βλαστοκυττάρων του ομφάλιου λώρου είναι ότι δεν χρειάζεται να έχουν απόλυτη συμβατότητα με τον λήπτη.
Η «ασθενής της Νέας Υόρκης», όπως ονομάστηκε από τους ειδικούς του Ιατρικού Κέντρου New-York Presbyterian Weill Cornell που της εφήρμοσαν τη θεραπεία, διαγνώστηκε θετική στον HIV το 2013 και τέσσερα χρόνια αργότερα διαγνώστηκε με λευχαιμία. Το 2017 έλαβε αίμα ομφάλιου λώρου από μερικώς συμβατό δότη για τη θεραπεία του καρκίνου της ενώ παράλληλα έλαβε αίμα από στενό συγγενή της σε συνδυασμό με τη μεταμόσχευση με στόχο την ενίσχυση του ανοσοποιητικού συστήματός της. Μετά τη μεταμόσχευση η λευχαιμία της γυναίκας βρισκόταν σε ύφεση για περισσότερα από τέσσερα έτη, ενώ τρία έτη μετά την υποβολή της στη διαδικασία διέκοψε τη θεραπεία για τον HIV και για περισσότερο από ένα έτος από τότε δεν είχε εμφανιστεί κανένα ίχνος του ιού στον οργανισμό της. Σύμφωνα με τους θεράποντες ιατρούς της, περί τους 50 ασθενείς ετησίως θα μπορούσαν να ωφεληθούν από τη διαδικασία αυτή μόνο στις ΗΠΑ και πολύ περισσότεροι παγκοσμίως.
Χαρτογραφήθηκε το 100% του ανθρώπινου DNA
Το ιστορικό Πρόγραμμα Ανθρώπινου Γονιδιώματος μόλις φέτος ολοκληρώθηκε
Τον περασμένο Απρίλιο διεθνής ομάδα επιστημόνων δημοσίευσε μέσα από έξι διαφορετικές μελέτες στην επιθεώρηση «Science» καθώς και σε άλλες επιστημονικές επιθεωρήσεις το πρώτο πλήρες ανθρώπινο γονιδίωμα το οποίο καλύπτει με ακρίβεια όλα τα χρωμοσώματα απ’ άκρου εις άκρον. Ετσι ολοκληρώθηκε ένα έργο που ξεκίνησε πριν από περισσότερα από 20 χρόνια με το Πρόγραμμα Ανθρώπινου Γονιδιώματος, στο πλαίσιο του οποίου είχε χαρτογραφηθεί ως το 2003 περίπου το 92% του ανθρώπινου DNA. Το υπόλοιπο 8%, το οποίο δεν είχε τότε αλληλουχηθεί, περιλαμβάνει αρκετά γονίδια και περιοχές επαναλαμβανόμενου DNA, ενώ είναι συγκρίσιμο σε μέγεθος με ένα χρωμόσωμα.
Το πλήρες γονιδίωμα προσθέτει σχεδόν 200 εκατομμύρια νέα ζεύγη βάσεων DNA, μεταξύ των οποίων 99 γονίδια που πιθανώς κωδικοποιούν πρωτεΐνες και σχεδόν 2.000 υποψήφια γονίδια που χρήζουν περαιτέρω διερεύνησης. Σύμφωνα με τους επιστήμονες της κοινοπραξίας, πίσω από το πρώτο ολοκληρωμένο ανθρώπινο γονιδίωμα η ύπαρξη μιας ολοκληρωμένης αλληλουχίας των συνολικά περίπου τριών δισεκατομμυρίων βάσεων («γραμμάτων») του ανθρώπινου DNA είναι ζωτικής σημασίας για την κατανόηση όλου του φάσματος της ανθρώπινης γενετικής ποικιλομορφίας, του γενετικού υποβάθρου νόσων αλλά και της ανθρώπινης εξέλιξης. Το επόμενο βήμα για τους ερευνητές είναι το να «διαβάσουν» την πλήρη αλληλουχία του DNA 350 ανθρώπων από διαφορετικά μέρη του κόσμου (Human Pangenome Project) προκειμένου να δημιουργήσουν ένα ανθρώπινο γονιδίωμα το οποίο θα είναι το πληρέστερο δυνατό καλύπτοντας την ανθρώπινη γενετική ποικιλομορφία.